TITRASI ASAM BASA
Titrasi adalah prosedur menentukan kadar suatu larutan. Dalam titrasi, larutan yang volumenya terukur direaksikan secara bertahap dengan larutan lain yang telah diketahui kadarnya (larutan standar). Berdasarkan jenis reaksi yang terjadi, titrasi dibedakan menjadi titrasi asam basa, titrasi pengendapan, dan titrasi redoks. Sobat Pintar, kali ini kita akan berfokus pada titrasi asam basa, yang tentunya tidak asing bagi kalian yang sudah duduk di kelas 11 IPA.
Pengertian Titrasi Asam Basa
Apa yang dimaksud dengan titrasi asam basa? Titrasi asam basa adalah penentuan kadar suatu larutan basa dengan larutan asam yang diketahui kadarnya. Atau sebaliknya, penentuan kadar suatu larutan asam dengan larutan basa yang diketahui, dengan didasarkan pada reaksi netralisasi.
Titrasi harus dilakukan hingga mencapai titik ekivalen, yaitu keadaan saat asam dan basa tepat habis bereaksi secara stoikiometri. Titik ekivalen umumnya dapat ditandai dengan perubahan warna dari indikator. Sementara itu, keadaan saat titrasi harus dihentikan tepat pada saat indikator menunjukkan perubahan warna disebut titik akhir titrasi.
Untuk memperoleh hasil titrasi yang tepat, maka selisih antara titik akhir titrasi dengan titik ekivalen harus diusahakan seminimal mungkin. Hal ini dapat diupayakan dengan memilih indikator yang tepat pada saat titrasi, yakni indikator yang mengalami perubahan warna atau trayek pH di sekitar titik ekivalen.
Sebagai contoh, pada label botol cuka makan umumnya terdapat informasi kadar cuka. Jika pada suatu botol cuka tertulis 25% asam cuka, bagaimana cara memastikan kebenaran kadar yang tertera tersebut?
Nah, penentuan kadar asam cuka dapat dilakukan dengan prosedur eksperimen menggunakan metode titrasi asam basa, Sobat Pintar.
Prosedur titrasi asam basa
1. Asam yang akan dititrasi dimasukkan dalam erlenmeyer, kemudian ditetesi indikator asam-basa yang sesuai dengan trayek pH.
2. Masukkan pentiter basa dimasukkan ke dalam buret, dan ditambahkan dalam erlenmeyer setetes demi setetes sambil menghitung berapa volume yang dibutuhkan.
3. Ketika warna indikator berubah, hentikan titrasi (titik akhir titrasi).
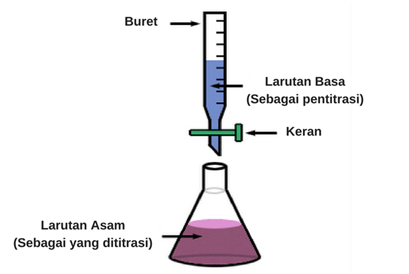
Source: blog.ruangguru.com/apa-itu-titrasi-asam-basa
Perubahan pH pada Titrasi Asam Basa
Pada saat larutan basa ditetesi dengan larutan asam, pH larutan akan turun. Sebaliknya, jika larutan asam ditetesi dengan larutan basa, maka pH larutan akan naik. Jika pH larutan asam atau basa diplotkan sebagai fungsi dari volum larutan basa atau asam yang diteteskan, maka akan diperoleh suatu grafik yang disebut kurva titrasi.
Kurva titrasi asam basa menunjukkan perubahan pH larutan selama proses titrasi asam dengan basa, atau sebaliknya. Bentuk kurva titrasi memiliki karakteristik tertentu yang bergantung pada kekuatan dan konsentrasi asam dan basa yang bereaksi.
Menggunakan Konsep Kemolaran Untuk Reaksi Kimia Dalam Larutan
Konsep kemolaran dan berbagai jenis reaksi kimia dalam larutan elektrolit, dapat digunakan pada perhitungan reaksi kimia dalam larutan.
Titrasi Asam Basa
Titrasi asam basa merupakan prosedur penting dalam analisis kimia untuk menentukan konsentrasi/kemolaran larutan asam/basa. Hal ini dilakukan demgan meneteskan larutan standar asam/basa yang kemolarannya sudah diketahui kedalam larutan asam/basa yang ke,olarannya akan ditentukan, menggunakan buret. Penambahan larutan standar dilakukan sampai mencapai titik ekovalen, yakni titik di mana asam dan basa habis bereaksi. Titik ekivalen dapat ditentukan menggunakan indikator yang harus berubah warna di sekitar titik tersebut. Titik di mana perubahan warnaindikator terjadi disebut titik akhir titrasi. Indiktor yang digunakan dalam titrasi adalah metil merah, bromotimol biru, dan fenolftalein.
Perhitungan Konsentrasi:
- Tulis persamaan reaksi antara larutan asam A dan larutan basa B
aA + Bb --> cC + dD + ...
- Nyatakan rumus untuk menghitung mol A dan mol B yang bereaksi
- Dari persamaan reaksi A dan B, perbandingan mol A dan mol B agar habis
bereaksi = a : b. Jadi diperoleh:
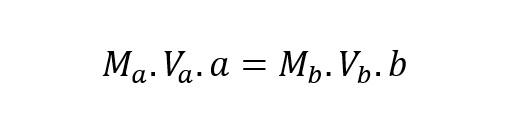
Keterangan:
M = kemolaran asam A dan basa B
V = volum asam A dan basa B
a , b = koefisien reaksi asam A dan basa B
Perhatikan, rumus ini juga dapat digunakan untuk menentukan konsentrasi suatu larutan basa dengan menggunakan suaru larutan standar asam.
Jenis titrasi ada 4 macam, yaitu:
1. Titrasi asam kuat dan basa kuat
2. Titrasi asam lemah dan basa kuat
3. Titrasi basa lemah dan asam kuat
4. Tirasi asam lemah dan basa lemah
Contoh soal Stoikiometri Larutan
Gas amoniak dapat dihasilkan melalui persamaan reaksi berikut:
(NH4)2SO4 + 2KOH --> 2NH3 + 2H2O + K2SO4
Reaksi berlangsung pada 0 C, 1 atm. Volume gas amoniak, NH3, yang dihasilkan setelah 33 gram (NH4)2SO4 (Mr = 132) bereaksi adalah ….
A. 2,8 liter
B. 5,6 liter
C. 11,2 liter
D. 12,0 liter
E. 22,4 liter
Pembahasan
Karena diketahui massa (NH4)2SO4, kita tentukan dulu nilai mol dari amonium sulfat tersebut.
mol (NH4)2SO4 = gr/Mr
= 33/132 mol
= 0,25 mol
Selanjutnya kita tentukan mol NH3 dengan memanfaatkan kesetaraan antara koefisien dan mol.
mol NH3 = 2/1 x mol (NH4)2SO4
= 2 x 0,25 mol
= 0,5 mol
Reaksi berlangsung pada 0 C, 1 atm, berarti berlangsung pada keadaan STP (standard temperature and pressure), volume yang digunakan adalah volume STP, yaitu 22,4 liter.
volume NH3 = mol x volume STP
= 0,5 x 22,4 liter
= 11,2 liter
Jadi, volume gas amoniak yang dihasilkan adalah 11,2 liter (C).













